骨髓是B细胞的发源地,同时也是哺乳动物B细胞分化成熟的中枢免疫器官。在骨髓内环境的作用下,按既定遗传顺序,从骨髓干细胞、前B细胞、未成熟B细胞,最终分化为成熟B细胞。其中经历了免疫球蛋白基因的重排、基因活化、转录表达等过程,最终出现特有的表面标志――B细胞抗原受体(BCR)。BCR也称表面膜之吱球蛋白(mlg)。成熟的B细胞能识别抗原,介导特异性免疫应答,具有合成、分泌抗体的潜能。
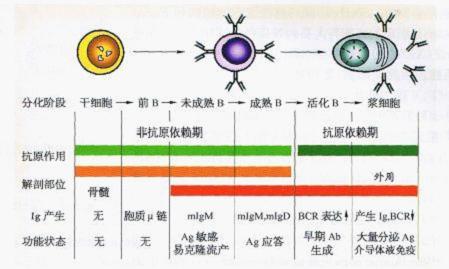
B细胞分化、成熟和抗原诱导的关系
1.前B细胞 在分化早期,Ig的重链--bt链的V区基因首先开始重排,胞质中出现u链,但还不能合成完整的Ig分子,不表达BCR,也不具有任何功能。//链V区基因的成功重排,可诱导免疫球蛋白的轻链――x链或入链的V区基因重排,并促进B细胞的进一步分化成熟。
2.未成熟B细胞 在重排的/i链基因的诱导下,Ig的轻链--g:链或入链的V区基因开始重排。此时,未成熟B细胞首先合成I链的替代链(surrogateLchain,SL),细胞表面表达前BCR(pre-BCR,由ptH和SL组成)。同pta一样,SL链的表达可抑制另一条重链基因的重排(等位排斥);促进B细胞的进一步分化、成熟;刺激轻链基因x链基因的重排。前BCR的表达促进B细胞的进一步分化成熟。随后,未成熟的B细胞能合成成熟的轻链,胞质中出现完整的IgM。同时细胞表面表达B细胞抗原受体mlgM。mlgM是B细胞分化成熟中首先出现的BCR,也是未成熟B细胞的表面标志。未成熟B细胞尽管已表达BCR,具有识别抗原的能力,但还不能介导免疫应答。相反,此时未成熟B细胞还处于一种对抗原的“易感”状态,如受抗原刺激,非但不能活化、增殖,产生特异性免疫应答,反而会引起未成熟B细胞发生细胞凋亡而导致克隆流产(clonalabortion)。现认为骨髓中出现的自身抗原,可去除对抗原“易感”的自身反应性B细胞克隆,这是B细胞自身耐受――中枢耐受产生的重要机制之一。
3.成熟B细胞 随着进一步分化,/l链以外的其他Ig重链的V区基因也开始重排、转录和表达。此时B细胞胞质中可同时出现IgM和IgD,表面可同时表达两类BCR--mlgM和mlgD。成熟B细胞能识别抗原、介导特异性免疫应答。
至此,B细胞完成在骨髓中的分化和成熟,并离开骨髓,到达外周免疫器官非胸腺依赖区定居。
4.活化B细胞 如无抗原刺激,成熟B细胞在外周免疫器官中寿命一般仅7~10d。而骨髓中成熟B细胞则源源不断进入外周,保持高度的自我更新速率,以维持数量庞大的多样性的B细胞库。同时,在抗原刺激下,B细胞的ig基因(V区)发生体细胞突变,进一步丰富了BCR的多样性。
一旦受到抗原刺激,B细胞可被活化,发生增殖分化,进入激活状态。此时,/z基因的转录速率加快,而B细胞表面BCR的表达则下调,向浆细胞分化。
5.浆细胞 浆细胞(plasmacell)又称抗体形成细胞(antibodyformingcell,AFC),是B细胞分化的终末细胞。此类细胞胞质中出现大量糙面内质网,能合成和分泌特异性抗体,介导体液免疫,同时表面BCR的表达减少。
从骨髓干细胞、前B细胞、未成熟B细胞到成熟B细胞,B细胞在骨髓特定的内环境中,按既定的程序分化,不受抗原影响,称为B细胞分化的非抗原依赖期(图2―11)。而在外周,成熟的B细胞只有在抗原刺激下才能进一步分化为浆细胞,分泌抗体,进入抗原依赖阶段。
已有实验证实,部分未成熟B细胞(mlgM+B细胞)可离开骨髓到达外周免疫器官,在外周继续分化、成熟;也可在外周经历B细胞的阴性选择。




