|
蛋白编号: |
||||||||
|
宿主: |
E.coli | |||||||
|
表达区域: |
Lys401-Lys621 |
|||||||
|
蛋白序列: |
KKLVPELNEKDDDQVQKALASRENTQLMNRD NIEITVRDFKTLAPRRWLNDTIIEFFMKYIEKSTP NTVAFNSFFYTNLSERGYQGVRRWMKRKKTQI DKLDKIFTPINLNQSHWALGIIDLKKKTIGYVDSL SNGPNAMSFAILTDLQKYVMEESKHTIGEDFDL IHLDCPQQPNGYDCGIYVCMNTLYGSADAPLD FDYKDAIRMRRFIAHLILTDALK |
|||||||
|
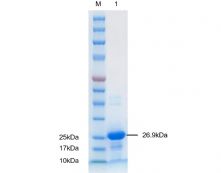
分子量: |
蛋白分子由230个氨基酸组成(含融合标签),预测分子量为26.9kDa,实际分子量与预测一致 |
|||||||
|
融合标签: |
6×His-SUMO (N端) |
|||||||
|
纯度: |
≥85% 还原型蛋白电泳 |
|||||||
|
物理性状: 液态 |
||||||||
|
组分: |
0.01M PBS+20%甘油,溶液无菌 |
|||||||
| 稳定 性: 分装后样品在-20℃至-80℃下的稳定性可达6个月,避免反复冻融 | ||||||||
|
应用: 抗体制备,免疫实验(ELISA,WB),亚细胞定位和互作蛋白鉴定等。 |
||||||||
|
内毒素: < 1.0 EU per ug of the protein as determined by the LAL method |
||||||||
别名
NIB1; Ulp1.
背景
小分子泛素相关修饰蛋白(SUMO)是一类泛素相关的蛋白质,通过结合赖氨酸侧链来调节靶蛋白的功能。SUMO化是一个可逆的翻译后修饰过程,在真核细胞内发挥着极其重要的作用,如转录、DNA修复、DNA重组、信号转导、蛋白质核转质运输和调节细胞周期等。近年来,SUMO已经成为一种有效的生物技术工具,通过SUMO与靶蛋白融合可以促进蛋白质折叠,增强蛋白质的可溶性表达,保护蛋白质免受蛋白酶水解,提高蛋白质的稳定性,已经成功表达了FGF21、EGF、KGF2等。且SUMO融合蛋白可以被SUMO蛋白酶Ulp1特异性识别并切割,因此SUMO可以作为用于蛋白质表达的理想标签。传统的蛋白酶如factor Xa、烟草蚀刻病毒蛋白酶(TEV)、肠激酶和凝血酶等常用于标签的切除,但传统蛋白酶识别特定的氨基酸序列,由于空间阻遏导致切割蛋白酶酶切效率不高。Ulp1与传统的切割酶不同,Ulp1识别SUMO三级结构,特异性的切割SUMO标签C端的异肽键。迄今为止,已经切开了100种SUMO融合蛋白,未发现错误的剪切。更重要的是,SUMO融合蛋白切割后,靶蛋白的N端不含有多余的氨基酸。对于医药蛋白,先决条件是仅含有天然氨基酸序列,因此SUMO作为融合标签对医药蛋白的表达及纯化有重要的意义。
1.Christopher M. Hickey, et al. Function and Regulation of SUMO Proteases. Nat Rev Mol Cell Biol. 2012 Dec; 13(12): 755–766.
点击右上角Datasheet

 Datasheet
Datasheet