背景
CGT(Cell and Gene Therapy)药物质量安全法规是全球化的,中美欧日趋于同步。目前,各经济体对本区域的药品生产和临床,逐步加强了涉及到的各种杂质的监控和检测。鉴于世界主要经济体的发展模式差异,和未来可能存在的风险。在求同的基础上,仍然需要进行中国生物药物产业供应链巩固,和加强上下游供应链的高效协作。详见《进口成本暴涨,看赛唐生物如何从“备选项”升级为“必选项”!》,《拒绝低效内卷:中国药企如何破局全球质量话语权之争?》。

NMPA与FDA等规定,药物的临床前期,可以使用通用型宿主细胞总蛋白(Host cell protein, HCP)检测试剂盒定量。而在临床期需要针对工艺锁定的特征型HCP做专属定制HCP抗体。为了进一步规范医药开发流程,提高生物药临床成功率和安全性,截止至2025年,新版《中国药典》发布后,CDE也进一步收紧HCP为代表的工艺杂质的监控程序,即对纯化步骤的每一步的HCP含量检测。可以预见,CGT等药物的审批日趋严格。
前瞻
赛唐生物经过对杂质核心HCP检测方法进行15年的研究和积累后,系统推出了生物大分子中,覆盖总蛋白,总DNA,总RNA,小分子化合物等药物全类型杂质的检测产品。形成了以三大表达系统HCP ELISA & HCD产品,污染物支原体检测QPCR,HCP核心标志物检测覆盖(Cathepsin D/B, PLBL2)为主,和周边HCP protein/peptide免疫刺激marker检测系统(IFNγ/TNF ELISA & ELISpot & LFIA)为辅的系统化产品,形成了稳健的生物药物细分领域的质量安全检测生态。见图1。
至此,主打HCP检测产品,已经覆盖全球生物药物主要表达系统。其中,基于疫苗等小众市场的酿酒酵母HCP,汉逊酵母HCP和Hi-5 HCP检测产品为国内独有。
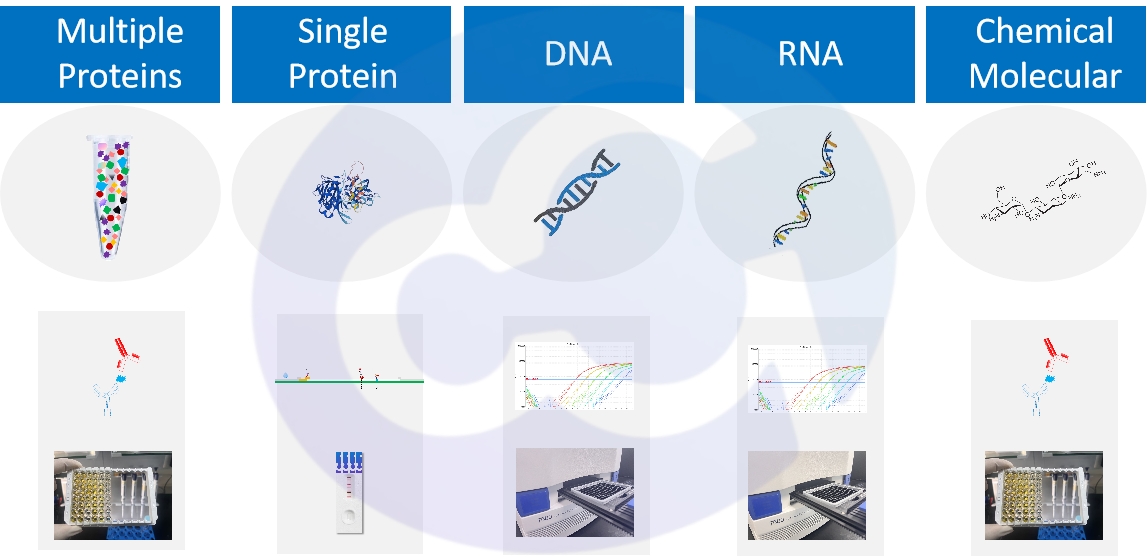
图1 杂质类型
风险因素类型
一、宿主来源
1、Host cell protein (HCP)
药物表达系统涵盖4大类:
(1)哺乳动物表达系统:小鼠物种:CHO;猴物种:Vero;人物种:293T,293,MRC5;
(2)原核表达系统:E.coli(3S),E.coli(6S);
(3)真菌表达系统:汉逊酵母,毕赤酵母X-33,毕赤酵母GS115,酿酒酵母;
(4)昆虫表达系统:Sf9,Hi-5。
赛唐生物系统进行了HCP性质表征和定量产品的研发,详见《全面解析中华仓鼠卵巢细胞(CHO)宿主蛋白(HCP)残留检测试剂盒》,《生物制药质控福音:高特异性酵母HCP ELISA方阵解决残留检测难题》,《本底“瘦身”计划:HCP ELISA开发记》,《填补市场空白!汉逊酵母 HCP ELISA,破解表达系统药物质控难题》,《E.coli HCP产品性能对比分析》,《Cellgene与Cygnus的HCP产品性能大比较》。

图2 表达系统宿主
.jpg)
2、Host cell DNA (HCD)
药物样本处理,可结合磁珠法前处理试剂盒,适用于3类宿主表达系统DNA纯化:
(1)哺乳动物表达系统:小鼠物种:CHO,NS0;猴物种:Vero;人物种:293;
(2)原核表达系统:E.coli;
(3)真菌表达系统:毕赤酵母,酿酒酵母。

图3 宿主HCD
.jpg)
3、Host cell RNA
宿主细胞外源核酸污染(含DNA与RNA),美国FDA、欧洲EMA和中国NMPA都要求对细胞来源杂质有明确的检测要求。总RNA的产品为E.coli RNA。相关技术文件,详见《纯净无杂质!专为E.coli优化的高质量总RNA残留检测试剂盒》。
二、High Risk Protein
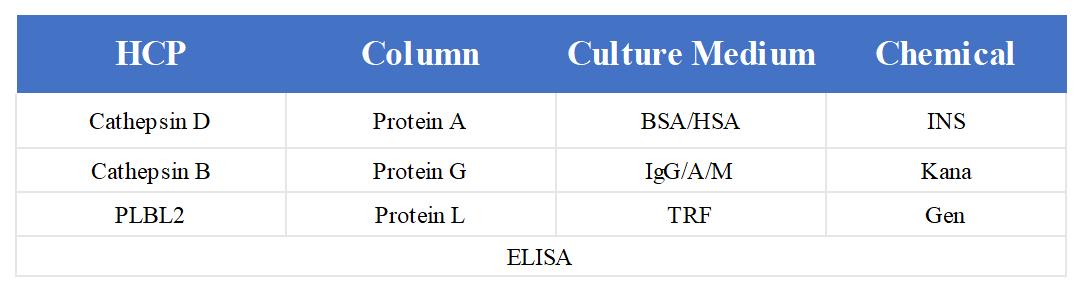
除了对总的HCP进行监控外,HCP和中间过程来源的常见的高风险因子蛋白,也是研究的必要监控对象。高风险因子蛋白大致可以分为三类:
(1) Host cell protein origin:Cathepsin D, Cathepsin B, PLBL2;
(2) Column origin: Protein A, Protein G, Protein L;
(3) Culture medium origin: BSA, HSA, IgG, IgA, IgM, TRF, INS,Kana,Gen。相关技术文章详见《新品推荐:单一蛋白Protein L残留检测试剂盒》。

图4 高风险因子类型
三、免疫分泌
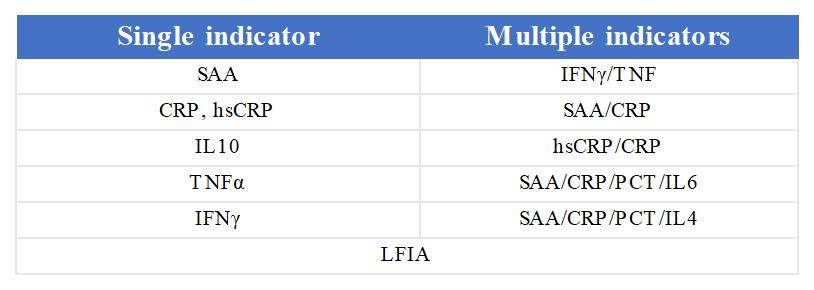
在药物免疫原性检测研究中,体外细胞实验的免疫刺激因子,是重要的评价指标。尤其是人物种来源细胞的因子分泌。根据使用灵敏度和便捷性等要求,赛唐生物推出了两大类产品,即:
(1)单指标:SAA, CRP, hsCRP, IL10, TNFα, IFNγ, PCT;
(2)多指标:IFNγ/TNF, SAA/CRP, hsCRP/CRP, SAA/CRP/PCT/IL6, SAA/CRP/PCT/IL4;

图5 LFIA系列
四、外源微生物
在CGT药物中,细胞改造和修饰,涉及多个步骤,所以有着极高的外源病毒和微生物污染可能。相比大分子抗体药物,CGT药物需要更精确、高效率和高灵敏度的检测方法和产品,来辅助药物安全。赛唐生物开发了支原体分析试剂盒,和支原体/衣原体/新冠病毒(N/S/E)/合胞病毒多重PCR联检分析试剂盒,适用于磁珠法抽提DNA和硅胶柱法抽提DNA试剂盒。相关技术文章详见《支原体“无处遁形”,荧光探针法qPCR检测试剂盒全新就位》。

图6 外源微生物
.jpg)
检测方法
由检测靶标分为单蛋白,多蛋白,核酸,多核酸,小分子化合物半抗原等类型,以及适应灵敏度,应用场景等因素,所以采用了多样化的检测,类型如下:
一、ELISA法
ELISA法,即,酶联免疫吸附实验,核心是双抗体夹心抗原,形成免疫复合物。根据反应信号大小和样本类型差别,可以分为聚苯乙烯微孔板的ELISA和ELISpot法。后者主要是针对药物的免疫原性对细胞免疫刺激,释放痕量细胞因子,在细胞培养介质中,被预包被的抗体所捕获,形成信号斑点。对应产品即为HCP和单蛋白ELISA。
二、QPCR法
针对核酸类靶标,采用实时荧光定量PCR法,结合特异性引物,酶体系成分,进行定量计算。产品涵盖表达宿主DNA,RNA和外源微生物DNA。辅助磁珠法和硅胶膜法,抽提核酸样本。对应产品即为HCD,HCR和支原体分析试剂盒。
三、LFIA法
LFIA法又分为抗原蛋白LFIA法,和PCR-LFIA法。即,基于硝酸纤维素膜和玻璃纤维系统,进行双抗体夹心抗原,并利用免疫复合物的金颗粒积累,读取光密度数据计算。对应产品为试纸条系列。PCR-LFIA法,即为继续PCR扩增系统,并结合LFIA法,形成的可视化和高灵敏度的方法,对应产品为多联病原微生物试纸条等。
四、电化学发光法
在宿主中的残留蛋白,不仅有增加药物免疫原性的风险,也会对药物和辅料有催化降解的可能。针对高度相关催化酶的活性验证,使之催化底物,形成电化学信号变化,并进行定量。对应产品近期即将推出。
支撑平台
目前,赛唐生物依托技术积累和硬/软件搭建,扎根于中国医药产业高地--张江基因岛,集中生产与研发的净化车间(图9),建立标准的生产质量管理体系(图10),系统升级免疫分析平台(图7)和PCR分析平台(图8)。
赛唐生物拥有近20年,ELISA技术产品沉淀。15年HCP产品研发周期。形成HCP产品,已经全面覆盖生物大分子药物表达系统。并将继续坚持聚焦生物药物质量领域,生成生物药物质量安全检测生态,为全球医药产业稳定供应优异性能产品。

图7 免疫分析平台
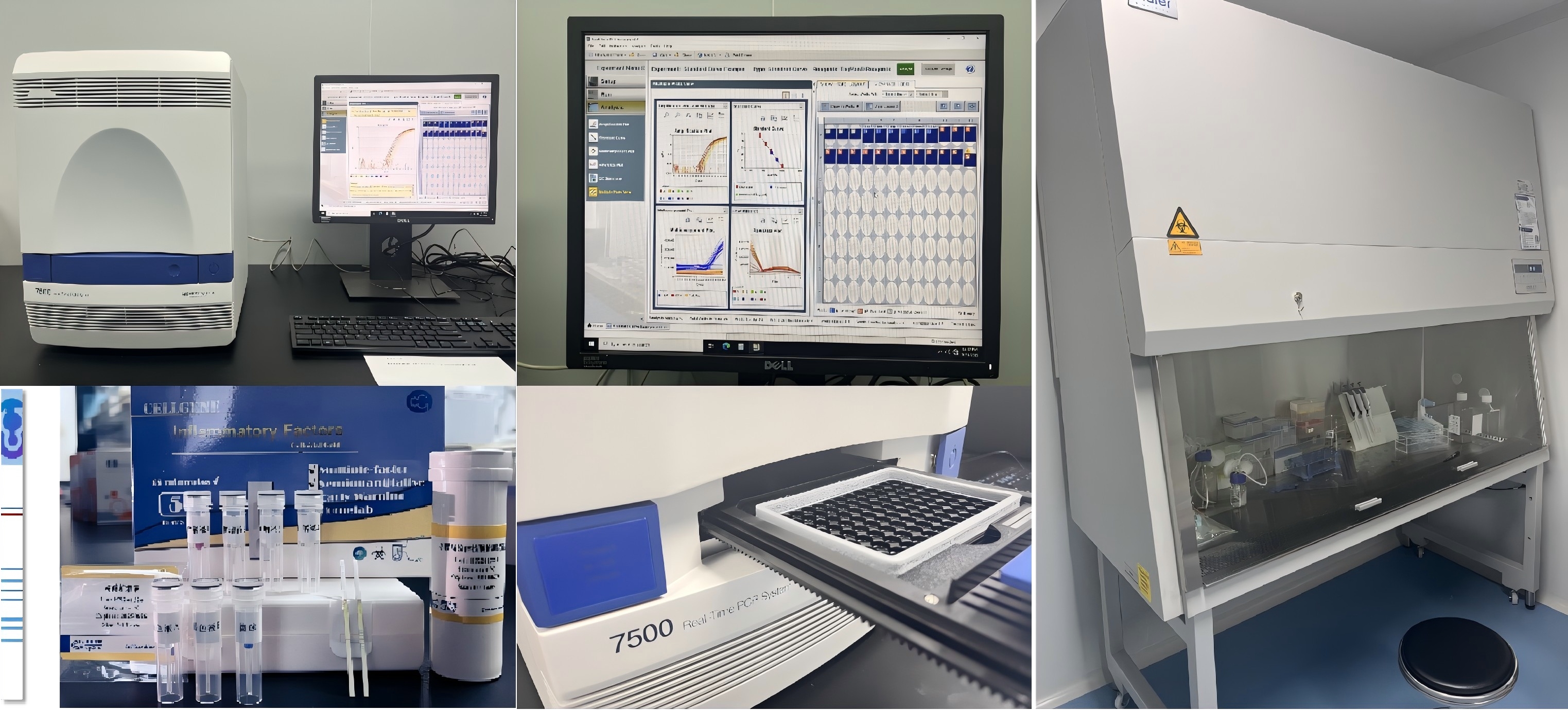
图8 PCR分析平台

图9 净化车间/实验

图10 体系标准化
参考标准:
ICH Q6B: Specifications: Test Procedures and Acceptance Criteria for Biotechnological/Biological Products.
ICH Q7: Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients.
ICH S6 (R1).
EMA: Guideline on Immunogenicity assessment of therapeutic proteins (2017).
FDA: Points to Consider in the Manufacture and Testing of Monoclonal Antibody Products (1997).
NMPA:《中国药典》2025版.

WEB:www.bluegene.cc
www.cellgenebio.com
E-mail:sales@bluegene.cc
TEL:400-882-6373 / 021-61106433




